النماذج الذرية
نموذج دالتون Dalton’s Model
نموذج دالتون Dalton’s Model
في عام 1803م، وضع دالتون نموذجاً ذرياً افترض فيه أن المادة تتكون من دقائق صغيرة غير قابلة للانقسام تسمى الذرات، وأن ذرات العنصر الواحد لها الصفات نفسها من حيث الشكل والكتلة والحجم، وتختلف في تلك الصفات عن غيرها من العناصر.

عيوب نموذج دالتون:
1- ذرات العنصر الواحد ليست بالضرورة متشابهة في الكتلة، فالعنصر الواحد يتألف من أكثر من نظير، وتختلف النظائر عن بعضها في الكتلة لاختلافها في عدد النيوترونات.
2- الذرة ليست أصغر جزء من المادة، فهي تتكون من إلكترونات وبروتونات ونيوترونات.

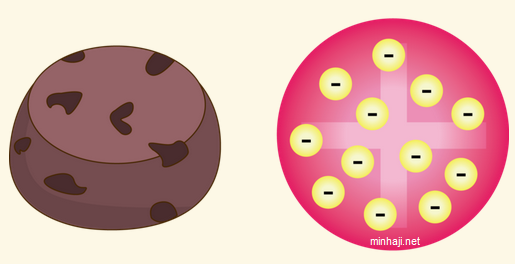
نموذج ثومسون Thomson’s Model
في عام 1900م قدم العالم ثومسون للعالم نموذجاً ذرياً افترض فيه أن الذرة جسم متجانس مشحون بشحنة موجبة تتوزع بداخله الإلكترونات سالبة الشحنة، بحيث يشبه هذا التوزيع انتشار حبيبات الزبيب في فطيرة الخوخ.
عيوب نموذج ثومسون:
1- الذرة ليست متجانسة.
2- لا يفسر النموذج الخصائص الكيميائية للعناصر.
ثالثاً: نموذج رذرفورد Rutherford’s Model
في عام 1907م اقترح العالم رذرفورد نموذجاً ذرياً افترض فيه أن معظم حجم الذرة فراغ تتوزع فيه الإلكترونات، كما تحتوي الذرة على نواة صغيرة الحجم تضم البروتونات وتتركز فيها معظم كتلة الذرة وتتوزع الإلكترونات حولها.

التحدي الأول الذي واجه نموذج رذرفورد:
ما القوى التي تبقي الإلكترون السالب بعيداً عن النواة الموجبة، فلا ينسحب نحوها ويندمج معها؟
لأجل ذلك اقترح رذرفورد الحركة الدائرية للإلكترونات حول النواة، والتي تولد قوة طرد عن المركز تعادل قوة جذب النواة الموجبة للإلكترونات السالبة.
التحدي الثاني الذي واجه نموذج رذرفورد:
تشير قوانين الفيزياء آنذاك إلى أن أي جسم يجب أن يفقد طاقة إذا تحرك، وبما أن الإلكترون أحد هذه الأجسام فإن حركته الدائرية حول النواة ستفقده طاقة باستمرار، وهذا يعني أن طاقة وضعه سوف تقل ويقترب مساره من النواة شيئاً فشيئاً إلى أن يتصادم معها فتنهار الذرة وينهار النموذج، وهذا ما لا يحدث فعلياً.

استمر البحث عن سبب عدم انهيار الذرة إلى أن تمت دراسة أطياف الضوء المنبعث عن ذرات العناصر المثارة Exited Atoms ، إذ إن إثارة ذرات العناصر بالتفريغ الكهربائي، أو التسخين المباشر بلهب، يؤدي إلى انبعاث الضوء من تلك الذرات.

وقد ألهمت نتائج تلك الدراسات العالم الدنماركي نيلز بور إلى وضع تفسير مقبول لوضع الإلكترونات في الذرة وعدم انهيارها، ولفهم أفكار بور، لا بد من دراسة مفهوم الطيف المرئي.





0 التعليقات:
إرسال تعليق